MITOCONDRIOGENESI: UNA POSSIBILE SVOLTA NELL’AFFRONTARE L’OBESITÀ
Per anni abbiamo pensato che il problema relativo all’obesità fossedovuto soprattutto ad un eccessivo apporto calorico.
Ora stiamo scoprendo che le persone obese hanno un difetto nel meccanismo che porta alla creazione dei mitocondri, le centrali energetiche delle cellule, quelle che trasformano i grassi e gli zuccheri nell’energia necessaria per far funzionare l’organismo.
Negli obesi i mitocondri non funzionano bene e le calorie ingerite non vengono utilizzate per produrre energia, ma si accumulano nel tessuto adiposo. Al tempo stesso, il cervello percepisce che la produzione di energia è scarsa e continua a richiedere cibo per fronteggiare la carenza energetica.
Il CSRO sta lavorando in questa direzione e, se questa ipotesi verrà confermata, sarà possibile sviluppare farmaci in grado di attivare la produzione di nuovi mitocondri funzionalmente attivi.
Il CSRO ha sviluppato una teoria innovativa, secondo la quale l’obesità non è necessariamente legata ad un eccessivo apporto calorico, che potrebbe rivoluzionarne la terapia

NO: UN NUOVO MEDIATORE NEGLI ADIPOCITI BIANCHI E BRUNI
Recentemente, le ricerche condotte presso i laboratori del CSRO hanno dimostrato l’importanza dell’NO nella funzionalità dei tessuti
adiposi. L’NO interviene sia negli adipociti bianchi (cellule di deposito di energia sotto forma di grasso, ma anche vere e proprie cellule endocrine in grado di rilasciare molecole ad attività ormonale, le adipochine) sia negli adipociti bruni (cellule termogeneticamente
attive, che bruciano i grassi per produrre calore, rilevanti per la sopravvivenza e implicate nella regolazione del bilancio energetico).
Le cellule adipose bianche e brune producono NO in situazioni fisiologiche, come l’aumentata attività del sistema nervoso simpatico.
Tale produzione è importante sia per la regolazione del contenuto cellulare di grassi (lipolisi) che per il controllo della proliferazione
cellulare e dei processi coinvolti nel differenziamento degli adipociti stessi. In particolare, l’NO è in grado di inibire la proliferazione e
la morte per apoptosi degli adipociti e di innescare la cascata di eventi molecolari che portano a un aumentato contenuto di mitocondri funzionalmente attivi.
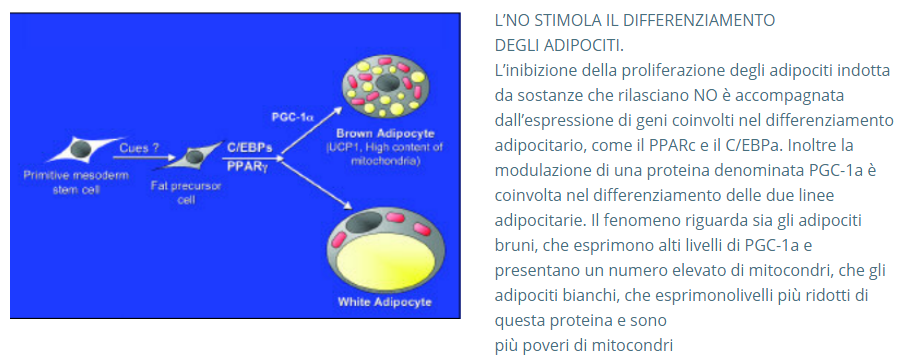

L’NO ATTIVA LA NASCITA DI NUOVI MITOCONDRI
I mitocondri costituiscono le centrali energetiche delle cellule: qui avviene la “respirazione cellulare”, la sintesi di molecole ad alto contenuto energetico come l’ATP, la degradazione dei grassi. Questi organelli intracellulari sono costituiti da due membrane, esterna e interna, differentemente organizzate a seconda del tipo di cellula che si considera e del suo particolare momento funzionale. Le membrane mitocondriali delimitano spazi funzionali importanti, tra cui la matrice che contiene
il DNA mitocondriale, che controlla l’espressione di alcune proteine coinvolte nella respirazione cellulare. La forma stessa dei mitocondri, più o meno allungati o rotondeggianti, varia a seconda della loro attività. Molti aspetti di questi organelli affascinanti restano da chiarire; tra questi,
i meccanismi che ne regolano la proliferazione. All’interno della cellula, infatti, anche il numero dei mitocondri varia a seconda delle circostanze e degli stimoli ricevuti. In particolare, il numero dei mitocondri raddoppia durante le fasi di replicazione cellulare, così che il numero degli organelli rimanga lo stesso per le cellule “figlie” neoformate. Il numero dei mitocondri aumenta anche nelle cellule muscolari durante l’esercizio fisico, indipendentemente dai processi di replicazione cellulare. Ancora, i mitocondri aumentano di numero e di funzionalità negli adipociti bruni degli animali esposti al freddo. In quest’ultimo caso l’aumento dei mitocondri stimola l’attività termogenetica e il dispendio di energia dell’organismo in toto. I risultati ottenuti dal CSRO suggeriscono
che l’aumento di NO all’interno delle cellule adipose brune (oltre che di altri tipi cellulari, tra cui gli adipociti bianchi e le cellule muscolari), ottenuto con la somministrazione di farmaci donatori di NO o con l’induzione artificiale dell’espressione di eNOS, induce la sintesi del PGC-1a, un cofattore che regola la produzione di fattori di trascrizione nucleari (Tfma,
mitochondrial transcription factor A; NRF1, nuclear respiratory factor-1) che aumentano l’espressione di proteine mitocondriali, innescando così la proliferazione dei mitocondri stessi.
